一、概述
非小细胞肺癌(NSCLC)占肺癌中的大多数,标准治疗方法有手术、放射治疗和药物治疗,包括细胞毒性化疗、靶向药物或根据肿瘤分子分型结果的免疫治疗。然而对于许多患者来说,不良反应往往会限制某些临床护理选择并降低生活质量。肿瘤电场治疗(TTFields)采用频率为 150 至 200 kHz 的交变电场,通过 2 对彼此正交放置的换能器阵列连接便携式电场发生器从外部施加到身体,在肿瘤细胞有丝分裂时破坏肿瘤细胞发挥抗癌作用。
TTFields 的疗效最初是在胶质母细胞瘤中进行研究,结果显示它可以延长新诊断患者的生存期。然而,人们对胸腔内 TTFields 的传播了解甚少。与浸泡在高导电性脑脊液中的大脑不同,肺泡和支气管内的空气是一种非导电介质,可能会改变 TTFields 的行为。本项目获取 4 名低分化肺腺癌患者的正电子发射断层扫描和计算机断层扫描图像数据集,通过图像处理创建大体肿瘤体积(GTV)、临床靶区(CTV)和从胸部表面到胸腔内的结构,然后使用有限元模拟研究电场的穿透能力和分布特性。
二、模型准备和模拟
2.1 图像获取
从癌症中心获取 4 名 NSCLC 患者的 DICOM 成像数据,用于回顾性影像学分析。本研究使用计算机断层扫描(CT)和正电子发射断层扫描图像,在 Simpleware 软件中对胸部各种组织的 CT 图像进行分割,然后与正电子发射断层扫描数据进行配准以勾画出 GTV。模型的准确性高度依赖于输入参数和用于勾画各种解剖结构的图像分辨率,因此在分割前将每个图像数据集超采样为 1 × 1 × 1 mm 的分辨率,使用切片之间的最近邻插值最大限度地减少体素边缘效应。
2.2 图像分割
胸内组织在患者个体间并不均匀,包括但不限于各种胸肌、皮质骨、松质骨、血管、气腔和心脏结构。单独分割气道结构(如隆突、气管)和血管(如下腔静脉、上腔静脉)作为空间参考的解剖标志。由于每个 GTV 的位置独特,模型之间存在 TTFields 异质性。在每个 GTV 周围均匀扩展 3 mm 作为 CTV,从而包含放射影像中不一定能检测到的亚临床微观疾病。将 CTV 和 GTV 之间差异的壳体积标记为 CTVp_ring,可应用各种建模条件且不干扰 CTV 中 GTV 的属性。
每个电极与皮肤表面之间有一层导电水凝胶的换能器阵列被手动放置在外部皮肤轮廓上,其中 20 个电极阵列分别放置在前、后、右外侧和左外侧。在一个阵列内,每个电极与相邻电极的中心径向相距2 cm。阵列放置方式的安排是为了减少患者模型中每个阵列与 CTV 的径向距离。
2.3 网格划分和模拟
在 Simpleware FE 为每个模型生成高质量的体积网格模型,设置最小四面体边长为 1.5 mm,最大四面体边长 ≤5 mm,目标最大误差为 0.05 mm。软件中更多的网格参数调控可以优化较小或不规则组织的质量,同时不影响每个模型中较大或光滑结构的计算时间。将网格模型导入 COMSOL Multiphysics 进行物理模拟,假设忽略磁场。初始条件包含假设不存在预先存在的电势,采用连续 150 kHz 的正弦波和 50 V 的峰-峰值分别作用于前-后和反向的后-前阵列,将等电位的正弦波施加到右-左侧面和反向的左-右侧面阵列。
2.4 GTV 变化模型
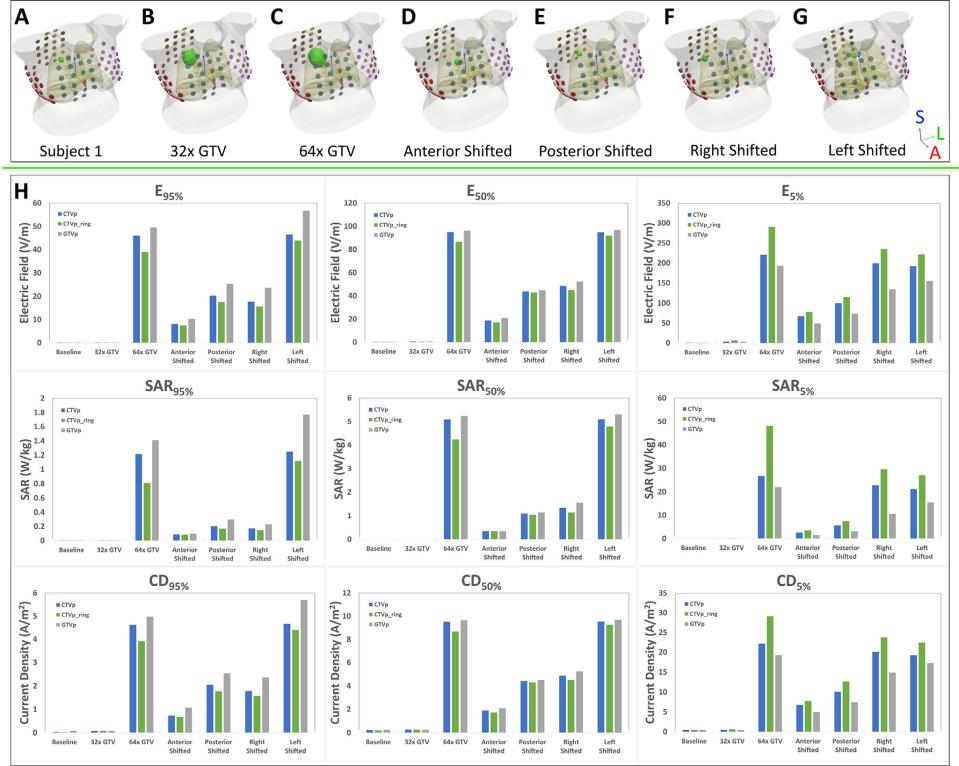
受试者 1 的 GTV 比其他模型小得多,边界远离胸壁、心包腔或膈肌。因此,生成原始体积 32 倍和 64 倍的膨胀模型,确定 GTV 的大小或位置是否是电场强度的主要决定因素。还通过在轴向平面虚拟移动(前、后、左、右)GTV 获得另外的四个模型。
三、结果
3.1 TTFields 分布差异
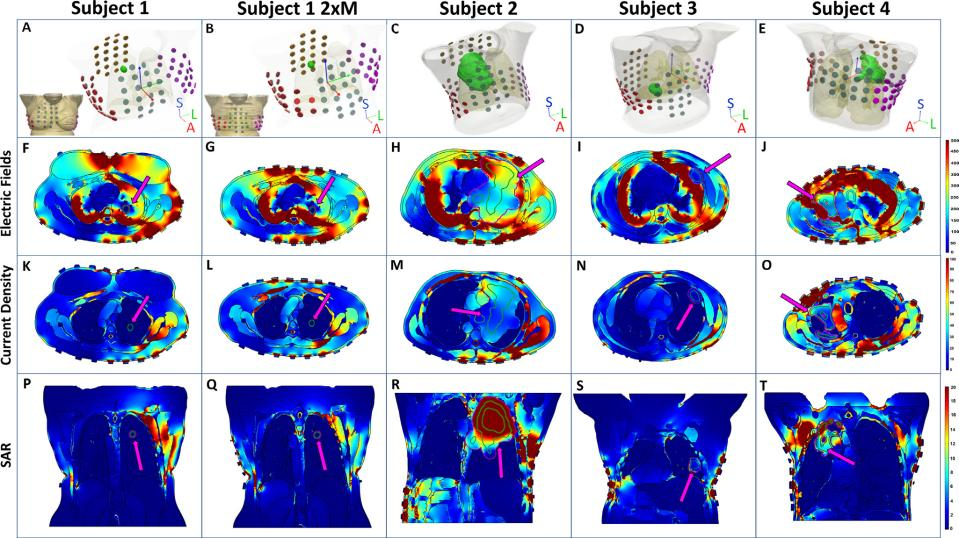
患者的 GTV 分别位于右上肺(受试者 1 和 2)、右中肺(受试者 3)和左上肺(受试者 4),这些成像数据集非常适合建模分析,因为都没有胸内病理或手术史,否则可能会扭曲胸部解剖结构的基线。生成的计划质量度量(PQM)包含特定组织结构的 95%、50% 和 5% 所接收的(1)电场强度 E95%、E50% 和 E5%(2)特定吸收率 SAR95%、SAR50% 和 SAR5%(3)电流密度 CD95%、CD50% 和 CD5%。
建模显示 GTV 处的 TTFields 分布在各个模型中相差多达 4 个数量级。受试者 1 的电场强度最低,受试者 2 的 E95% 和 E50% 最高,受试者 4 的 E5% 最高。SAR 和 CD 的结果分布与电场强度一致,受试者 1 的低 PQM 可能与其 GTV 尺寸较小及与胸膜分离有关。因此,GTV 的电场、SAR 和 CD 数据表明胸腔内肿瘤的位置可能是影响 TTFields 输送的重要变量。分析 CTV 中 TTFields 分布发现 PQM 有类似模式,证实了 GTV 中的初步观察结果。

3.2 肿瘤与胸膜分离的影响
接下来研究导致受试者 1 中 TTFields 较低的因素,并注意到患者的乳房增大了胸围。与其他模型相比,胸部 CT 显示皮肤和胸腔之间有大量脂肪和软组织。通过去除分割的乳房并在胸壁和皮肤之间留下约 1 cm的软组织获得虚拟移除乳房的受试者 1 模型(Subject 1 2×M)。移除乳房会使 GTV 中 TTFields 强度略有增加,如电场强度 E95% 增加 4.3%,E50% 为 1.4%、E5% 为 27.4%,未观察到任何 SAR 或 CD 的变化。而包含 GTV 的 CTV 中 CD95% 显著增加 128.8%,E5% 增加 45.3%,其余 PQM 均略有增加。虚拟双乳房切除术模型显示乳腺组织可能是导致 TTFields 强度衰减的一个因素。
假设从肿瘤到换能器阵列的径向距离可能是 TTFields 对 GTV 和 CTV 覆盖范围的另一个决定因素。测量 GTV 质心到每个阵列中心电极的距离、相对阵列中心之间的距离、GTV 中心轴平面处前后和侧面皮肤距离、患者模型在中心轴平面的周长并取平均值。尽管已进行虚拟双乳房切除术,但所有测量结果均未显示 Subject 1 2×M 模型与其他模型数值存在显著差异。
将受试者 1 的 GTV 体积扩大至 32倍和 64 倍,64 倍模型 GTV 的 TTFields 强度显著增加,而 32 倍模型并没有显著增加。使用原始 GTV 对肿瘤进行 4 次虚拟位移,每次均与胸膜腔部分接触。产生 TTFields 强度增加最大的是左移,最小的是前移。在所有情况下,移动 GTV 使其与胸膜腔齐平接触会导致 TTFields 强度急剧增加。
3.3 CTV 的电导率和质量密度
由于组织成分的异质性,患者肺癌肿瘤的电导率可能存在很大差异。一般来说,随着 CTV 电导率的增加,每个目标体积的电场强度都接近 0,很可能是由于电荷保持能力的丧失。然而,各个模型之间存在明显差异,4 个肺模型中 TTFields 特征的模式各不相同。因此,个性化建模对于精准确定个体患者的 TTFields 分布必不可少。

壳体积 CTVp_ring 混合了肿瘤、肺组织和空气,这三种物质的电导率值差异很大,因此它可能比 GTV 或 CTV 更具有异质性。通过改变 CTVp_ring 的电导率并保持 GTV 的电导率恒定为 0.1 S/m 进行敏感性分析。结果表明,CTVp_ring 是肿瘤处 TTFields 覆盖的主要决定因素,且在各个患者中差异很大。

SAR 与质量密度成反比,还通过改变 CTVp_ring 的质量密度进行敏感性分析,范围从 1 kg/m3(空气)到 2000 kg/m3(皮质骨)。所有患者模型的 SAR 随着质量密度的增加而降低,而 GTV 处的 SAR 保持不变,表明周围组织的质量密度变化并不影响 GTV 内的 SAR。
四、总结
本研究揭示了 TTFields 分布的多样性,证明靶体积电场穿透的异质性,在 NSCLC 患者中差异高达 200%。在敏感性分析中,改变 CTV 的电导率和质量密度会引起 GTV 和 CTV 覆盖范围的变化。因此,个性化建模对于准确预估肺部肿瘤体积和胸部周围正常组织结构的 TTFields 靶区覆盖率非常重要。
五、参考
- Lok E, Liang O, Malik T, et al. Computational analysis of tumor treating fields for non-small cell lung cancer in full thoracic models[J]. Advances in Radiation Oncology, 2023, 8(4): 101203.
