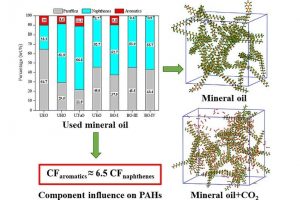
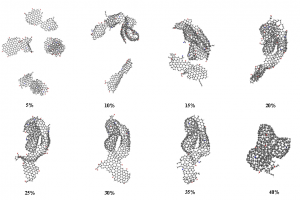
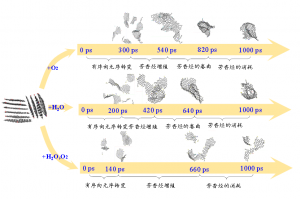
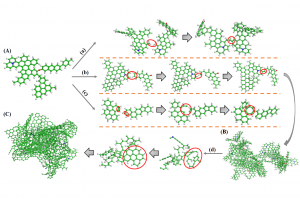
摘要 通过热解回收废旧矿物油是一种灵活有效的方法。然而,在这个过程中可能会产生具有高毒性的多环芳烃(PAHs)。本工作试图通过ReaxFF分子动力学(MD)模拟揭示矿物油热解过程中矿物油的演化过程和多环芳烃的形成机制。此外还探讨了加热速率(10 K/ps、100 K/ps和~1000 K/ps)、温度(2200~3200 K)、矿物油成分(环烷烃和芳烃含量)和大气(CO2)影响多环芳烃形成的原理。观察到矿物油的两阶段热解演化:第一阶段分解,第二阶段聚合反应。高温可以使热分解快速转化为聚合反应阶段。通过跟踪关键中间体/产物和芳香结构的演变发现,在矿物油热解过程中,氢提取-乙烯基自由基加成(HAVA)反应主导了PAHs的形成。此外,连接在碳簇上的支链基团的缩聚环化对大的PAHs的形成做出了相当大的贡献。乙烯基加成和缩聚脱氢是矿物油热解过程中PAHs形成的两个标志性反应。矿物油中芳烃组分对多环芳烃形成的贡献约为环烷组分的6.5倍。CO2可以通过中间体/产物的氧化以及随后的乙烯基/乙炔加成反应对脱氢的抑制来减少PAHs的形成。 参考文献 Formation mechanism of polycyclic aromatic hydrocarbons during mineral oil pyrolysis: A ReaxFF molecular dynamics study, Linlin Xu, Gan Wan, Lushi Sun, Li Lin, Fuel, 2024, 131175, DOI: 10.1016/j.fuel.2024.131175
利用分子动力学模拟研究微波辐射对焦炭气化机理的非热效应(Renewable Energy,2023)
简介 含碳固体燃料(煤炭,生物质,石油焦,含碳废物)的精细化利用是未来能源发展趋势。水蒸气气化技术可以将固体燃料转化为更加清洁的气体燃料(CO,H2)。近年来,微波加热技术由于其高效和易控制特性而被引入气化技术中。除了微波热效应外,有学者发现微波对气化反应具有显著的非热效应。而交变电场对焦炭气化反应的化学层面的作用是微波非热效应机理的关键。燕山大学赵登课题组通过分子动力学模拟和量子化学计算探究了焦炭在电场作用下的气化机理。研究发现:电场的存在可以显著促进焦炭气化反应,电场的促进效果随电场强度的增大成指数增大。有意思的是,交变电场对气化的影响不仅仅来源于电场本身,电场的方向和强度变化会显著促进反应过程。同时对于气化的副反应,电场对水煤气反应和水解反应都有着明显的促进效果。 研究内容 本研究中所有的分子动力学模拟均使用AMS软件的ReaxFF模块,在C/H/O/N力场下进行模拟。从伊利诺伊州6号煤焦芳香烃片层模型中选取了的10个芳烃片层,建立初始的焦炭模型C1037H241N10O26,添加2800个H2O分子。为了将电场场强变化和方向变化分离开,设置了正弦、方波与恒强三种波形以及不加电场的空白对照组;同时设置了不同的电场强度,以研究场强大小对气化过程的影响。为了尽可能地将非热效应与热效应隔离开来,使用Berendsen控温器进行加电场的NVT系综的恒温分子动力学模拟。 图1 波形示意图(a)恒强(b)方波(c)正弦 图2 焦炭模型和水分子模型结构(C:灰色;H:白色;O:红色) 图3 不同场强作用下的气化反应过程的碳转化率变化 图3表示了3000K下不同波形体系在1ns内的碳转化率,图中可以直观的看到三种电场对气化的影响存在着差异,这体现出了微波自身的不同属性(场强大小变化,方向变化)对气化反应的影响不同。综合来看,在相同的温度下,电场的引入可以显著促进气化反应,这体现出了微波对于焦炭气化反应的非热效应,正弦电场对焦炭气化反应的促进作用是三种波形电场中最显著的。除了电场本身对气化有影响,电场的场强变化及方向变化都会对气化过程有促进作用。 图4 3000K下不同场强对气化反应过程的碳转化率的影响(a)正弦电场系统中碳转化率与电场强度的关系(b)方波电场体系(c)恒强电场体系(d)500ps下的碳转化率与电场场强的关系图 从图4(a)~(c)可以看出随着场强的增大,电场对气化反应过程的促进越明显。但是可以看出在0.01场强之前电场对气化反应过程促进作用较弱,超过0.15之后,电场的促进作用显著增大,这表明场强对气化的作用可能存在一个阈值。图4(d)显示,对于所有三种场类型(正弦波、方波和恒强电场),随着电场强度的增加碳转化率成指数增长。焦炭的微波气化过程中在电场强度达到一定程度之后,焦炭所受到的电场的影响程度会急剧升高,这可能是因为,焦炭碳边缘的碳氧复合物结构受场强的影响很大,随着场强变化芳香性破坏。 图5 反应过程中正弦电场体系与无电场体系中碳环数量的变化 对反应过程中的碳环数量进行了统计,如图5,可以看出:正弦电场体系中6元环的消耗要快于无电场体系,这证明电场的引入促使6元环破坏,形成不稳定的5元环与7元环,从而促进了气化过程。因此电场可以通过影响焦炭边缘的稳定性促进气化。环结构的稳定性与芳香性是相关联的。 图6 3000k下焦炭在不同电场作用下的水蒸气气化产物随时间变化分布图 在焦炭水蒸气气化过程中,气化剂产生的含氧自由基为O自由基与OH自由基,这两种自由基作为活性物质将O携带吸附到Char边缘。从图6中可以看出波形对于O自由基和OH自由基的生成影响不大。但加电场后对于OH自由基和O自由基的生成都有很明显的促进作用,无电场体系中没有搜索到O的生成,加电场后OH自由基的含量分别约为无电场体系4-5倍。 图7 无电场作用下的气化反应路径 图8 正弦电场作用下的气化反应路径 对无电场体系与正弦电场体系气化路径进行了分析。无电场体系与正弦电场体系对比,无电场体系中,CO的生成过程如图7,其大致为羟基吸附到活性位点然后析出CO,正弦电场体系中有较多O自由基直接吸附到C原子上并破坏碳环的现象,如图8中的A和C路径,因此O自由基的活动可能是正弦电场促进气化反应速率的一个因素。相同反应路径下,正弦电场的体系气化反应的脱附过程要比无电场的体系快10倍左右,例如图7中的B路径与图8中的B路径。 (a) (b)图9 3500K(a)无电场体系与(b)正弦电场体系中焦炭形态随碳转化率的演变图 图9(a)为无电场体系中焦炭形态随碳转化率的演变图,可以看到随着反应的进行焦炭的形态由松散逐渐变得紧凑,多数片层相连形成大的片层,其中存在片层堆叠的情况,当碳转化率到15%时出现了卷曲结构,在碳转化率为20%-40%期间这个卷曲结构进一步卷曲堆叠使结构越发紧凑,使裸露的边缘活性位碳位点减少,碳转化率到达到40%时形成球状结构,边缘碳活性位点进一步减少,气化反应是从焦炭边缘开始进行,而卷曲与堆叠行为在边缘位置减少的前提下,更多碳被包裹很难接触到外界水蒸气,反应会进一步变慢。图9(b)展示了正弦电场体系中焦炭形态随碳转化率的演变情况,在相同转化率下,焦炭结构在正弦电场体系中比无电场体系更松散,碳转化率由5%到35%并没有出现堆叠与卷曲现象,其主要的变化为片层相连形成二聚体或三聚体。因此电场引入通过对片层间的卷曲与堆叠行为的削弱影响气化反速率。 图10 Char模型范德华表面静电势分布(a)未施加电场(b)平行于Char平面强度为250 a.u.的电场(c~f)垂直于Char平面,电场强度依次为150,250,350,450 a.u.(1 a.u.≈ 51.423 V/ Å) 为了探究吸附过程中电场对于焦炭边缘电荷分布的影响,利用简化的焦炭模型的DFT计算获得的电子波函数,对波函数进行图形化处理得到焦炭边缘范德华表面的静电势分布如图10所示。无外加电场下,在氧原子处形成负电势,其余碳边缘上形成正电势。在垂直于Char平面方向施加电场后(图c),碳边缘正电势极值较无电场时由22.39kcal/mol增大至26.65kcal/mol,并且随着电场强度增大,逐步增加至66.61kcal/mol。边缘静电势的增大加强了对含氧自由基的吸附。在平行于Char方向施加电场使得焦炭平面两侧电子逆电场方向发生转移,产生静电势极化现象,在两侧形成较大的正/负静电势(-60.39kcal/mol,89.61kcal/mol),这远大于同场强下垂直方向电场的碳边缘静电势,这表明了沿焦炭平面方向的电场是促进气化吸附过程的主导因素。 图11 垂直于Char平面的不同电场下Char模型的定域化共轭π电子轨道等值面图(lol-π=0.3)(a)无电场(b)平行于Char平面强度为250 a.u.的电场(c~f)分别为垂直于Char平面强度依次为150,250,350,450a.u.的电场 图12 成环原子(C3,C4,C7,C8,C9,C10)的多中心键级及Char形态变化 简化模型焦炭分子平面具有共轭π电子轨道,通过分析共轭π电子轨道,可以直观显示焦炭芳香性的变化,芳香性决定了分子的稳定程度。图12可以看出,随着场强增大,多中心键级在150-250 a.u.电场场强下变化较小,达到350 a.u.场强之后开始减小,450 a.u.场强下大幅减小为负值,从图11(f)来看,450 a.u.场强下碳环上的π键完全破坏,导致了多中心键级的剧变。所以电场能够通过破坏焦炭边缘的芳香性来促进气化的脱附过程。另外,焦炭平面和碳氧复合物扭曲方向与电场方向相关,在正弦电场或方波电场中电场方向在不断改变,这造成焦炭分子会在不同方向上发生扭曲震动,焦炭边缘碳氧复合物会在这样的震动下不断被拉扯,从而更容易脱离焦炭边缘。 总结 本文通过AMS软件的ReaxFF模块对焦炭微波气化总体过程进行了等温模拟研究,并对气化过程进行分解,分别对吸附过程,脱附过程和水煤气反应进行了单独模拟研究来分析微波在各个反应中的作用。通过DFT的方法研究了电场对焦炭分子的影响。研究发现: 焦炭的微波气化过程要比非微波气化过程快8~10倍,电场的场强大小变化和方向变化对气化过程有明显的促进作用,且两者的作用可以叠加,相同场强下正弦电场对气化过程的促进效果最佳;电场强度对微波气化过程的影响成指数变化。电场主要通过两方面促进气化吸附过程,一方面促进O自由基和OH自由基的生成,进而促进了气化过程的吸附过程,另一方面电场使Char发生极化进一步促进吸附过程;电场可以显著加速脱附过程的进行,电场的方向变化对脱附过程也有可观的促进作用,电场的引入会使焦炭边缘的芳香性与多中心键级发生变化,达到一定的场强后芳香性被破坏,多中线键级突变,这解释了气化反应速率与场强的指数关系,此外电场对碳氧复合物有一个动力学的拉扯作用,这进一步促进了脱附过程的进行。电场的引入对于水煤气反应具有明显促进作用,且电场场强变化与场强大小变化都有明显作用,并且发现恒强电场对水的解离过程促进效果更佳。 参考文献 Jian S ,Deng Z ,Haoyuan F […]
利用反应力场模拟和同位素示踪法探究焦炭在混合气氛气化中H2O-Char与O2-Char的相互作用(Fuel 2023)
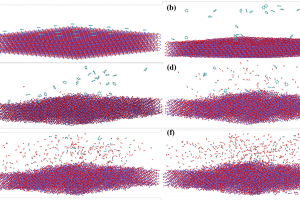
相关背景 气化是一种在高温下生产合成气的含碳固体燃料热化学转化技术,且污染物排放量非常低,这种技术已经被广泛应用在发电领域。理想单一气氛气化在实际工业中应用很少,大部分是混合气氛气化,在混合气化过程中多种气氛反应之间的相互作用机理尚不明确。燕山大学赵登课题组采取实验和模拟相结合的方式来探究H2O-Char与O2-Char协同作用机理。研究得出在混合气氛下,水蒸气的存在抑制了O2-Char气化,而氧气对H2O-Char气化起到明显的促进作用。在H2O/O2气氛中,混合气氛整体气化反应性是由O2对H2O-Char的作用与H2O对O2-Char的作用叠加共同决定的。 实验研究 本研究首先利用微型流化床和在线质谱仪开展气化实验,研究了单水、单氧和混合气氛下焦炭气化速率,为了剥离Char-H2O气化与Char-O2气化的相互影响,更好地观测到O2和H2O分别对于Char-H2O气化和Char-O2气化的影响,采用氧同位素示踪技术,将混合气氛O2/H2O单独标记,研究Char-H2O气化与Char-O2相互之间的单一影响。利用原位漫反射傅立叶变换红外光谱(DRIFTS)实验,检测混合气氛下Char-H2O/Char-O2反应路径之间的相互影响。 AMS模拟 利用AMS软件ReaxFF模块进行分子动力学模拟进行实验结果验证。首先,从Fidel Castro-Marcano等人通过透射电镜建立的煤焦模型中选取7种多芳烃层(C127H25O2、C115H25NO3、C111H25N2O2、C107H25NO2、C99H24NO3、C94H23NO3、C84H22NO3)。然后将其堆叠在一起,形成初始的焦炭模型C1037H241N10O26。模拟使用的是NVT系综。将焦炭模型定位在周期性盒子中,随机添加小分子,建立3种不同气氛比例的反应系统。为了在所有反应系统中维持相似的压力,系统密度均设定为 0.15 g/cm3。图1是4%O2/20% H2O体系、4%N2/20% H2O体系和4%O2/20% N2体系的模型图。每个反应系统首先在300 K下进行20 ps的弛豫,然后在3500 K下进行1000 ps的ReaxFF MD模拟。采用CHON-2019力场用于描述 Char/O2/H2O 反应体系。 图1 (a) 4%O2/20% H2O体系,(b) 4%N2/20% H2O体系,(c) 4%O2/20% N2体系(焦炭模型中,C:灰色,H:白色,O:红色,N: 蓝色;H2O:以黄色标记整个分子;O2:以青色标记整个分子) 图2表示的是不同气氛下C的转化率和转化速率随时间的变化。在不同气氛下C的转化率可以用公式(1)来描述。由图2可知,在反应初期,混合气氛下C的转化速率大致相当,随着反应的进行,不同混合气氛下C的转化速率开始发生变化。混合气氛(20%H2O + 4%O2)>混合 气氛(20%H2O + 2%O2),说明氧气的加入对于整体的气化性是促进作用。这与前文的气化性试验的规律一致。 其中,X表示C转化率,YCO、YCO2、YC1-4和YZ分别表示CO的数量,CO2的数量,C1-4的数量,总的C原子数。 图2 不同气氛下碳的转化率 在AMS软件输出的数据表格中,对CO和CO2中氧的来源进行标记追踪,通过比较不同来源的产气可以获得Char-H2O与Char-O2反应之间的相互作用。CO中O的来源只有三种,分别来源于Char、H2O、O2。与CO相比,CO2中O的来源较为复杂,分别有H2O+O2、H2O+Char、O2+Char、H2O、O2、Char六种。对比O来源不同的CO与CO2的数量,分析O2-Char和H2O-Char之间的影响。 图3表示的是焦炭在混合气氛下CO与CO2生成曲线。在混合气氛下气化, CO和CO2中的氧产生主要是来源于H2O气化和O2气化。产气CO和CO2只有小部分(<20)来源于焦炭自身。 图3 焦炭在混合气氛下CO与CO2生成(COO2代表氧来源于O2的CO) 由图4a可知,在不同气氛下COO2+COO22的产量整体上是增长的趋势,但是产量差异较大。相比于单氧气氛,水蒸气的加入使得COO2与COO22的产量明显减少。这表明在混合气氛下,水蒸气的存在明显抑制了氧气的气化。与同位素实验所得“水蒸气的存在抑制了氧气的气化”结论相吻合。 图4 不同气氛下COO2+COO22和COH2O+COH2O2的产量随时间的变化 由图4b可知,在不同气氛下COH2O+COH2O2的产量整体上是增长的趋势,产量略有差异。相比于单水蒸气气氛,氧气的加入使得COH2O与COH2O2生成速率更快,产量更高。这表明在混合气氛下,氧气对焦炭-水蒸气气化起到一定的促进作用。 图5 不同气氛下焦炭结构的变化 图5表示的是单氧(20%N2+4%O2)、单水(20%H2O+4%N2)和混合(20%H2O+4%O2)气氛下,焦炭结构的变化情况。 在单氧与单水气氛中焦炭结构均呈现为多个芳香烃片与片之间的连结形成更大的芳香烃结构;而在混合气氛中焦炭结构则表现为芳香烃片未连结、独立存在的结构。说明在混合气氛下,芳香烃片与片之间更难连结形成更大的芳香烃。在混合气氛气化过程中氧气可以抑制由水造成焦炭结构的卷曲,降低焦炭的芳香度,使得焦炭结构呈平面网格结构,增加了焦炭边缘活性位点的数量,从而增强气化反应性。这也与原位实验所得“氧气会破坏芳香环的共轭结构,降低焦炭的芳香度”结论相对应。 通过分子动力学模拟得到焦炭气化反应路径,例如图6表示的是混合气氛气化过程中焦炭边缘气化反应的某一路径。初始反应涉及来源于氧的O与多环芳烃片上的C相连形成六元环(图6a),然后C-O键的断裂形成了C-C=O的支链(图6b),最后来源于水的OH与支链上的C结合,脱离出CO。而该现象在这两种气体反应路径中普遍存在,因此,可以认为在混合气氛中普遍存在同一反应区域的相互作用,氧气易于开环,水再与支链反应。 图6 混合气氛气化过程中焦炭边缘反应路径-1(260 ps ~280ps)(H2O:整个分子用黄色表达,黄色原子都来源与水分子;O2:整个分子用青色表达,青色的原子都来源于氧分子) 在焦炭-H2O/O2混合气氛气化中,O2促进焦炭中的芳香环的裂解,形成了更多的脂肪链状碳,降低焦炭的芳香度,使得由O2形成的O基团和煤焦形成更多的碳氧复合物C(O),从而形成了更多的活性位点,即增加了煤焦表面活性位点的数量,促进了煤焦-H2O的气化反应性。这也与原位实验所得“氧气会破坏芳香环的共轭结构,形成脂肪链状碳”这一结论相对应。 总结 […]
【中南大学肖劲-仲奇凡教授课题组】锂离子电池用导电炭黑微观结构建模及基于ReaxFF与DFT的电化学反应机理研究(Energy & Fuels 2023)
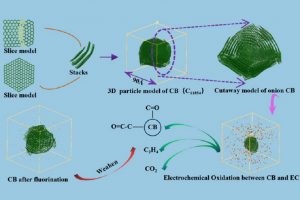
摘要 中南大学肖劲-仲奇凡课题组,通过高分辨率透射电子显微镜(HRTEM)、XRD、拉曼光谱和XPS实验检测,探讨了导电炭黑的结构特征。条纹的CB晶格长度大多<20Å,峰值约为10Å。条纹在0–360°处均匀分布,符合其“洋葱状”结构。总共堆叠了2-5层,平均堆叠数量为2.91,具有一定的顺序。弯曲条纹总长度的比例为67.13%,高于总数的比例(46.57%),表明弯曲条纹一般较长。然后通过构建CB(C11854)的洋葱状颗粒模型,结合FT-IR和XRD光谱计算验证了该模型的合理性。 作者同时在理论方面,采用基于反应力场的分子动力学(AMS软件ReaxFF模块)研究了CB和碳酸亚乙酯(EC)在锂离子电池中的电化学氧化行为。EC通过环内和环外O攻击CB,EC的分解产生CO2和C2H4。CB表面形成了各种O基团,EC和CB的破坏影响了电池的循环稳定性和寿命。在使用F2作为CB的保护后,EC的消耗减少,并且在CB表面仅形成少数O基团。这一结果为减缓CB和EC之间的电化学副反应提供了高精度的模拟支持。 扩展阅读: 中文详细解读:https://mp.weixin.qq.com/s/df7GchOCPdT_kVCdgKBNZw英文文献全文:Construction of a 3D “Onion-like” Model of Conductive Carbon Black for Lithium-Ion Batteries and Exploration of the Electrochemical Oxidation Mechanism of CB and Ethylene Carbonate via ReaxFF MD, Energy & Fuels. 2023, 37, 9, 6778–6790
【中南大学仲奇凡教授课题组】改质煤沥青的分子结构建模及其原子尺度的焦化机理研究(Fuel 2023)
相关背景 煤沥青是煤焦油蒸馏工艺的副产品,由于其具有含碳量高、杂元素含量低、廉价且来源广泛等优势。对煤沥青进行改质可以获得更高的结焦值和软化点,改质煤沥青是石墨电极、碳纤维、碳纳米管、C/C复合材料等高附加值碳制品的重要优质原料。改质煤沥青的焦化是制备高附加值碳素产品的必经工序,它决定了产品的真密度、机械强度、电导率、石墨化度等性能。探索改质煤沥青焦化机理对优化高附加值碳材料的制备工艺具有重要意义。然而,现有科学文献对MCTP的微观结构组成及焦化过程的深度演化机制研究较少,本文精确构建了改质煤沥青的分子结构模型,并基于ReaxFF分子动力学方法对改质煤沥青的焦化机理在原子尺度上进行了深度研究,为实现改质煤沥青更高值化的利用,以及高附加值碳材料制备工艺的改进提供理论了依据。 研究亮点 通过一系列的检测分析(XRD, 13C NMR, FT-IR, XPS, MALDI-TOF-MS等)获得了MCTP的微观结构特征和组成。MCTP的碳骨架主要由芳香结构组成,芳香结构单元主要为苯和萘。脂肪族结构主要以甲基和亚甲基的形式存在。MCTP的分子量分布集中在1500 Da范围内。MCTP中含O、N和S的官能团分别以醚、季氮和无机硫的形式存在。在此基础上,建立了能够表征改质煤沥青微观结构特征和组成的分子模型(C93H59NO)。利用AMS2019软件中ADF模块计算改质煤沥青分子模型的量化性质,得到的13C NMR和FTIR图谱与实际检测结果吻合,验证了模型的合理性。 运用所建立的分子模型、ReaxFF MD模拟(AMS2019软件ReaxFF模块)、TG-MS、XRD和SAXS分析,揭示了改质煤沥青焦化过程中的挥发份去除及结焦机理。改质煤沥青焦化过程中挥发物的去除是由改质煤沥青分子边缘结构的破坏和活性自由基的产生引起的。主要挥发产物为H2、H2O、CO、CH4和C2H4。挥发分主要在430 ~ 900 K的温度范围内析出。对于焦化过程,XRD和SAXS分析表明,沥青焦样品的结晶和石墨化程度在挥发分去除阶段(低于973 K)被破坏,在高温阶段(>高于973 K)得到改善,Lc、Nc、La、Rg和孔隙率在1573 K时分别达到3.81 nm、12.03 nm、1.68 nm、18.54 Å和9.9%。在ReaxFF MD模拟过程中,沥青焦核的真密度(最终为2.2 g/cm3)、RDF临界峰强度、sp2杂化键比例(最终为41.4%)和六元环比例(最终为63.3%)均呈现先下降后上升的趋势。实际检测分析(XRD、SAXS)和ReaxFF MD模拟得到的结论可相互映证。沥青焦核的形成可分为两个阶段:焦核的形成阶段和有序化阶段。在形核阶段,改质煤沥青分子中的开环反应和脂肪链的交联导致了初级焦核的形成,主要通过三条反应路径,在路径一中,芳香烃通过芳香甲基直接连接;在路径二中,由边缘六元环断裂形成脂肪链,然后通过脂肪链结合实现芳烃的聚合;在路径三中,两个芳烃边缘的C原子相互结合形成五元或七元环结构。在有序化阶段,在初级焦核内会发生缩聚和芳构化反应,最终形成沥青焦微晶核。 图1 文章摘要图 图2 研究流程示意图 图3 改质煤沥青分子结构模型及验证 图4 改质煤沥青结焦机理图 参考文献 Zihan You, Jin Xiao, Gang Wang, Zhen Yao, Ye Wan, Qifan Zhong, Molecular representation and atomic-level coking evolution investigation of modified coal tar pitch […]
AMS2023版发布
AMS(Amsterdam Modeling Suite)发布了2023正式版,在ReaxFF分子动力学、材料力学性质模拟、化学反应分析与探索,以及DFT高精度计算尤其是GW方法、RPA近似方面有所改进。更详细的新功能介绍与教程,我们将会在AMS知识库中逐渐新增。 计算引擎 机器学习力场 M3GNet-UP-2022 几乎适用于所有材料升级的ASE 接口用于AMS、PLAMSQuantum ESPRESSO 7.1 (适用于 Linux/Mac)TASKCC 泛函:提供更好的原子化能量分子体系DFT计算:r2SCAN-3c(STO)RPA 近似:sigma-functional限制性开壳层分子计算(要求整数占据,自旋极化>0),及其TDDFT计算溶剂化方法 3D-RISM 计算焓、溶剂化自由能TD-DFT+TB 激发态结构优化分析: 新的 NOCV 选项, 基于 SFO 的准粒子轨道, 新的PolTDDFT 分析选项,开壳层 IQA(Interacting Quantum Atoms) 光谱:GW-BSE: Bethe Salpeter equation:G0W0-BSE, evGW-BSE, qsGW-BSE,含自旋轨道耦合ECD谱(含自旋轨道耦合)开壳层杂化泛函计算激发能的HDA近似,能够节省大体系计算量磷光发射等Franck-Condon谱计算:自动考虑振动激发量子数周期性体系DFT计算:自洽迭代收敛性改进增加了 GTO 基组选项MP2、RPA 近似、GW 方法计算分子 有机电子学 qsGW+BSE 精确计算激发能(可考虑自旋轨道耦合)OLED workflows 更多新工具(包括更精确的电子态、激发态性质,以及GPU加速的LAMMPS分子动力学)振动极化率 化学反应 ACE-Reaction: 反应网络的快速预测分子动力学纳米反应器:通过球形约束反应器的周期性的膨胀收缩,加速气相、液相、超临界相化学反应事件发生。势能面探索与表征工具:局部最小值、一阶鞍点、高阶鞍点创建动力学数据作为 CatalyticFOAM 输入,用于反应器尺度的模拟改进 ChemTraYzer2:布居统计统计指定化学键、分子数量变化曲线PyZacros:集成到 AMS 中,用于模拟催化表面分子现象的动力学Monte Carlo软件 分子动力学 摩擦系数计算杨氏模量、剪切模量、体模量、泊松比、屈服点的计算 流体与药物设计 新的构象搜索/结构筛选/热力学玻尔兹曼平均光谱的计算COSMO-UNIFAC 方法发布:UNIFAC 参数中可选QSPR预测液体粘度、蒸汽压,以及三相点温度、合成难易程度、溶度参数、等张比容、介电常数等 粘度预测值与实验值符合的较好 AMS最新应用案例 ADF 应用案例:分子与团簇 DFT […]
【宁夏大学白红存教授课题组】基于ReaxFF MD模拟探索化学链燃烧中芳香族片段解聚的反应机制及复杂反应网络(Journal of the Energy Institute 2023)
1. 计算模型和方法 图1. 芳烃分子在铁基载氧体表面的化学链燃烧反应模型 文中选取化学链技术中最常见的Fe2O3载氧体。构建α-Fe2O3(001)低指数晶面。以Fe-O3-Fe…为反应表面的稳定结构扩胞得到初步铁基载氧体颗粒模型。然后将多环芳烃放到Fe2O3载氧体表面,然后再进行5×5超胞。ReaxFF MD模拟的周期性盒子设定为100 Å×100 Å×50 Å。如图所示,Fe2O3载氧体总共8层16000个原子,其中氧原子9600个,Fe原子6400个。载氧体上面共有25个多环芳烃。多环芳烃选择了固体燃料中具有代表性的4种多环芳烃,这些多环芳烃在许多煤分子结构是常见的。 主要对CLC过程反应器内Fe2O3和多环芳烃体系反应过程ReaxFF MD模拟。计算采用郑等开发的包含C/H/O/Fe等元素的ReaxFF力场参数,以及NVT正则系综分子动力学(NVT-MD)方法进行计算。计算中,步长为0.25 fs,温度由阻尼常数为0.1 ps的Berendsen恒温器控制。模拟反应温度分别为2000、2500、3000、3500、4000 K,探究不同温度Fe2O3载氧体和多环芳烃反应特性。反应前计算模型在450 K进行了40000步非反应(Non-reaction)弛豫过程,使其处于平衡状态。ReaxFF MD模拟过程累积1000000步,总时长250 ps。 图2. 多环芳烃的模型 2. 结果讨论 图3 . 多环芳烃S1反应的过程 图3是多环芳烃在Fe2O3载氧体表面反应的可视化过程。根据截取的0、25 、 75 、125、175、250ps时CLC体系实时图片,燃烧过程可分为四个阶段。通过上述化学链燃烧不同阶段的反应物和产物分析发现,这些多环芳烃分子和铁基载氧体化学链燃烧过程可分为四个阶段。第一个阶段属于反应前阶段,主要发生载氧体颗粒和燃料分子的结构弛豫和扩散。该过程使得体系中载氧体颗粒和燃料分子中化学键呈现键合-解离-键合的动态平衡特征。这将有助于它们在后续过程中参与反应。第二阶段属于初始反应阶段。此阶段多环芳烃自身开始逐步发生热裂解反应,生成自由基和含碳碎片。同时,部分燃料分子或反应碎片与载氧体表面的晶格氧距离靠近,形成有效相互作用,进而形成化学键连。载氧体开始发生反应逐步释氧 。第三阶段属于剧烈燃烧反应阶段。此时多环芳烃在高温环境中大量裂解成分子碎片。载氧体大量释氧同步发生。整个化学链体系呈现剧烈燃烧反应的特征。第四阶段属于最终燃烧阶段。此时大部分多环芳烃已裂解成碎片。主要发生的反应为大量含碳碎片中间体物种的氧化燃烧。该过程生成大量典型燃烧最终产物,如CO,CO2,H2O等。 图4. 基于多环芳烃S1反应中C…C相互作用的RDF分析 为了系统了解不同芳烃燃料分子在化学链燃烧过程中分子结构变化,对燃料分子S1在CLC过程中不同反应时间体系的C…C相互作用距离进行了径向分布函数(RDF)分析。RDF在约1.4 Å 处的峰可反映体系中C-C键的数量变化,并表征芳烃燃料分子的热分解反应动力学。 在50 ps时1.4 Å处峰的强度仍2500。这表明此时燃料分子中C-C数量不变,燃料分子尚未解离。在75/ 100/ 125/ 150/ 175 ps时,RDF中1.4 Å处峰的强度分别为2000,1700,300,120和40。这表明反应过程中燃料分子中C-C数量减少,燃料分子逐步解离发生燃烧反应。通过RDF和 C-C键数量变化分析,可以很好地反映上述化学链燃烧反应的四个阶段。 图5. 基于多环芳烃反应中反应物分子数量变化(图A是S1反应中分子数量变化图;B是S2反应中分子数量变化图;C是S3反应中分子数量变化图;D是S4反应中分子数量变化) 研究发现,CLC反应温度对燃料分子参与化学链燃烧反应影响显著。燃料分子随CLC温度升高呈现参与反应提前现象。从燃料分子反应数量可发现,随着CLC温度升高,芳烃分子参与反应越早。例如,S1分子在3500 K时,在50 ps开始反应分解,而2000/2500/3000 K时则分别为62.5,62.5,50 ps。因此,S1分子在3500 K的反应分别比2000/2500/3000 K提前了12.5,12.5,0 ps。同时还发现,CLC温度对于燃料分子分解时间具有影响。分析燃料分子反应数量可发现,随着CLC温度升高,芳烃分子全部参与CLC反应耗时减少。例如,S1分子在3500 K时,在50 ps开始反应分解, 137 ps体系无S1分子。S1分子全部参与反应并分解总耗时87 […]
ReaxFF:蛋白质聚集体热解产生超轻气凝胶(Materials Today 2022)
概要 二维(2D)石墨烯(G)和一维(1D)碳纤维(CF)集成的新型碳结构,具有优异的应用潜力,但无法直接制造这样复杂的架构,因此在很大程度上需要进一步的探索。最近普林斯顿大学Craig B. Arnold等人,将基于描述性/预测性的全原子反应分子动力学模拟(ReaxFF+蛋白质力场)的计算化学方法与实验结合起来,从多学科角度对这一问题进行了挑战性的探讨,发现了令人鼓舞的现象: 大分子蛋白质聚集体中的相互作用,为设计和制造复杂多孔材料,提供了独特的机会,且无需外部模板和昂贵的后处理。研究人员将新鲜鸡蛋中的蛋白加工成了可伸缩的、无缝连接的、具有双重孔隙度的分级G-CF气凝胶。 基于AMS(Amsterdam Modeling Suite)ReaxFF模块的模拟,准确地再现了这些结构,与实验结果一致性良好,并证明具有分层结构的多孔形态存在多种潜在应用可能性。 参考文献 S. Ozden et al., Egg protein derived ultralightweight hybrid monolithic aerogel for water purification, Materials Today 2022, DOI: 10.1016/j.mattod.2022.08.001
超临界流体的不均性分布及其对反应行为的影响(JACS Au 2022)
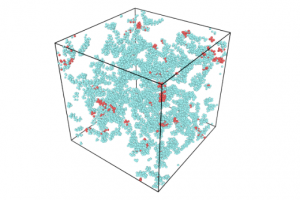
研究背景 超临界流体因其特殊的性质,已经广泛应用于化学工程行业中。以热裂解反应为例,如石化炼炉,高性能燃烧容器等装置内发生的热裂解反应,往往发生在超临界流体中。已有大量实验研究报道,超临界条件下的热裂解反应在反应速率及反应产物等方面,显著差异于常压气相下的热裂解反应。然而,解释这些由于相态区别导致的反应行为差异,尚为超临界领域内的一个难题。为此,有必要从超临界流体本身存在的特殊微观流体结构出发,对其微观分布与特异反应行为的关联进行研究,为拓宽超临界流体的应用提供理论基础。 基于此,天津大学化工学院刘国柱教授团队提出了一种结合机器学习与分子动力学的模拟策略:通过集群变量驱动元动力学(CVHD)模拟超临界流体在真实工况条件下的反应过程,准确描述了超临界热裂解的特殊反应行为,并通过深度神经网络对原子局部环境进行学习,将超临界流体从原子尺度划分为“类液原子”与“类气原子”,揭示了拥有特殊局部环境的“类液原子”在超临界流体反应中的重要作用,理论性地解释了超临界反应的特殊反应行为。该研究结果对于深入探索超临界流体及相关反应具有重要的理论意义。 研究内容 首先,作者利用AMS软件ReaxFF模块中提供的集群变量驱动元动力学算法(CVHD),模拟了真实工况条件下(1000 K),气态及超临界态代表性碳氢燃料组分正癸烷的热裂解反应过程,并追踪了反应中的主要产物分布,构建了两种反应条件下的反应机理网络。相较于气态热裂解反应,超临界态下的反应中,诸如氢提取反应,双自由基加成反应等双分子反应所占比例显著提高,导致反应产物中大分子烷烃数目增加,产物烷/烯比增加,符合实验结果。 为解释超临界态热裂解反应的特殊行为,选择深度神经网络对真实气相、液相原子的局部环境进行学习,构建二元分类器,对超临界流体进行筛分。筛分结果表明,超临界流体并非均匀单相,而是由“类气原子”与“类液原子”交织共存形成的泡沫状结构。随着流体所处环境压力的改变,流体体密度发生变化,所含“类液原子”的比例也随之改变,并呈现出S型变化趋势。 图1. 超临界流体中的类气、类液原子分布(a)3 MPa; (b) 15 MPa; (c) 30 MPa 进一步地,对超临界态反应中大量增加的双分子反应进行追踪分析,发现双分子反应集中发生于“类液原子”及其近邻原子所构成的“类液区”中。后续分析发现,“类液原子”拥有与液态相似的局部环境,其较高的局部密度保证了足够的有效碰撞几率,促进了双分子反应的有效进行,并最终导致超临界态反应的特殊反应行为。 图2. 典型双分子反应的定位及原子种类划分。其中(a), (b)为反应追踪及定位;(c), (d)为类气/液原子划分结果。 小结 该工作结合机器学习与反应性分子动力学模拟,从超临界流体的微观分布特殊性出发,解释了超临界态反应的特殊反应行为。集群变量驱动元动力学算法有效地拓展了模拟时长,使真实工况下的反应模拟成为可能。深度神经网络分类器则描述了超临界流体的不均性微观分布,并确定了超临界流体中特有的“类液原子”,以及其与双分子反应之间的联系。该研究结果从微观层面完善了对于超临界态反应的了解,广泛地拓展了超临界流体及其反应的应用空间。 参考文献 Yutong Wang, and Guozhu Liu*, Inhomogeneity Effects on Reactions in Supercritical Fluids: A Computational Study on the Pyrolysis of n‑Decane, JACS Au, 2022, DOI: 10.1021/jacsau.2c00359 感谢天津大学化工学院刘国柱教授课题组博士生王宇桐同学供稿!
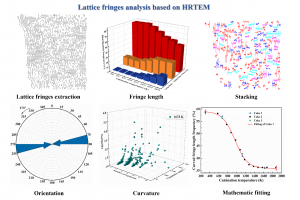
基于HRTEM探究多温度段煅后石油焦的微观结构特征演变及多尺度建模(Fuel 2022)
相关背景 煅烧是制备石墨产品的一个重要过程,煅烧后的石油焦是如锂离子电池负极、钢铁冶炼热电偶、稀土电解槽槽体和铝电解炭阳极等炭素材料的优质原料。 现有研究已表明,煅烧会使石油焦的物理和化学性质发生一系列的变化:焦体中的挥发物和水分被大量去除,导致体积收缩、密度增加;芳香烃在煅烧过程中先后经历热解、聚合和重新排列,导致导电性提高; H、O、N和S等杂质元素也可在高温下脱除,导致焦体骨架抗氧化性提高。 然而,现有的关于温度对煅烧焦的影响的研究,大多数是基于传统实验,演变规律的探究主要基于对实验结果的推测。对于不同温度段煅后焦微观结构特征的演变规律,需要通过更先进的检测方法进行深入分析。建立精确的微观模型,是进一步利用材料计算模拟方法探究微观反应机理的基础。 研究亮点 中南大学仲奇凡教授课题组基于HRTEM检测,分析了不同温度段煅后焦晶格条纹的长度、堆叠、方向和曲率的变化。发现温度在289~1873 K间,平均条纹长度、堆叠占比、45度集中分布频率和弯曲条纹占比的值分别从7.36 Å、10.26%、44.91%和58.74%变化到12.03 Å、50.63%、98.71%和36.13%。数学拟合被用来连续和定量地分析微观结构特征的变化规律。在873~1873 K的温度区间内,微观结构特征的变化规律与Logistic回归模型拟合良好。根据拟合曲线的趋势,尽管大多数微观结构特征在873 K以下经历了轻微的不良变化,但在873 K以上,微观结构特征进行了较大程度的有益演变,提高了结构有序度。此外,拟合曲线的数学方程可以可靠地计算出给定温度段下的各项特征值。 图1 基于HRTEM对多温度段煅后焦微观结构特征演变进行分析 通过HRTEM图像引导的自动化建模、AMS软件中ADF模块的结构优化和ReaxFF模块的分子动力学驰豫等方法,成功建立了煅后焦的分子尺度(约70个原子)模型、微晶尺度(3990个原子)三维模型和纳米尺度(31909个原子)三维模型。模型中的H/C比率、官能团比例、微量金属含量、真实密度和结构特征等与实际数据相似。利用ADF模块计算出煅后焦分子模型的FT-IR图谱,再利用芳香族H和脂肪族H的峰面积之比可计算出分子模型的芳香度,其值与实际检测结果相近,利用相关脚本可计算得到三维模型的XRD图谱,其特征峰位置与实际图谱基本一致。以上多方面验证证明了所建模型的合理性,这样的多尺度模型精确表征了煅后焦的微观结构,并可应用于碳材料反应过程的计算模拟研究。 参考文献 Microstructural features transformation at various temperature stages and multi-scale atomistic representations of calcined petroleum coke based on HRTEM, ZihanYou, JinXiao, QiuyunMao, XiuzhenZhang, QifanZhong, Fuel, 2022, Volume 330, 125521 感谢中南大学仲奇凡教授课题组犹子涵博士供稿!