概述
NF 2相关神经鞘瘤病(NF 2-SWN)是一种罕见的常染色体显性遗传疾病,由染色体 22q12 上的 NF 2 基因突变引起,特征是神经系统肿瘤,如前庭神经鞘瘤(VS)、脊髓脑膜瘤和周围神经肿瘤。VS 患者可能听力丧失、耳鸣、面部麻痹、以及预期寿命缩短。
鉴于典型测量肿瘤大小方法(线性分析和体积分析)的局限性,准确追踪肿瘤生长的 3D 体积分析越来越受欢迎,但因耗时耗人力限制其在临床实践中的应用。本研究基于人工智能(AI)和机器学习(ML)算法对数据集进行训练,开发自动分割和计算 VS 肿瘤 3D 体积的方法,大大缩短时间并提高图像处理精度。
图像处理
创建概念验证数据集
真实数据集为从耶鲁纽黑文医院和公众招募患者中获得的 143 个 MRI 图像数据,所有用于概念验证(POC)的图像均为 T1 加权增强 MRI 扫描。图像质量由研究人员确定,根据体素大小进行分类:高质量(小于 0.5 × 0.5 × 1.0)、中等质量(小于 1.0 × 1.0 × 1.0)和低质量(大于 1.0 × 1.0 × 1.0)。
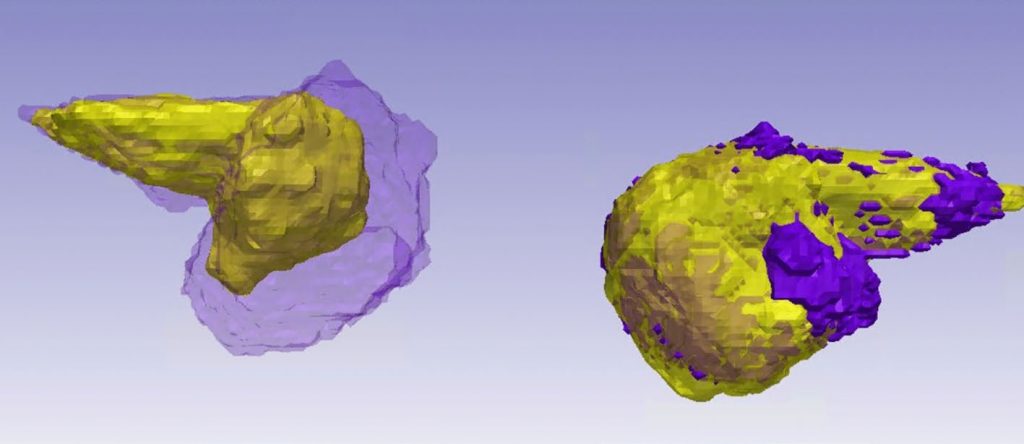
将图像数据导入 Simpleware 软件创建肿瘤模型,为突出显示 VS,在包含肿瘤块的选定切片上应用阈值分割,使用 Split regions 工具分离出肿瘤并去除非肿瘤区域体素。考虑到掩膜边界的体素,使用 Paint 工具通过在切片视图的涂画调整缺失和多余的体素。所有模型都由神经放射科医生审查并进行必要的修正。对于分割后的肿瘤掩膜,使用 Volume 工具直接获得其测量的 3D 体积。为可视化肿瘤的形状、大小和生长模式,还创建了脑桥掩膜。使用度量如 DICE 系数将 Simpleware 输出与真实数据注释进行验证。
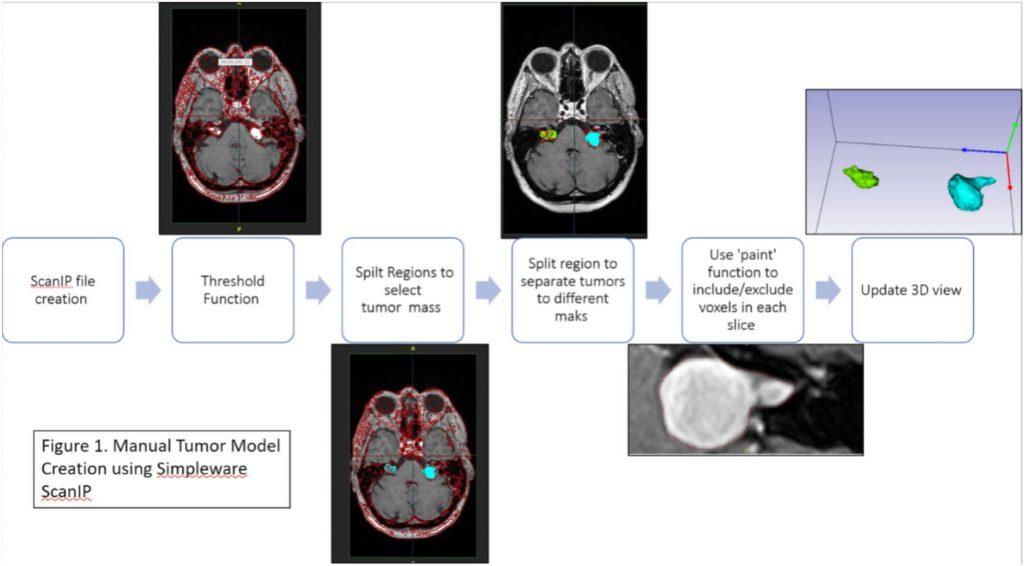
创建原型
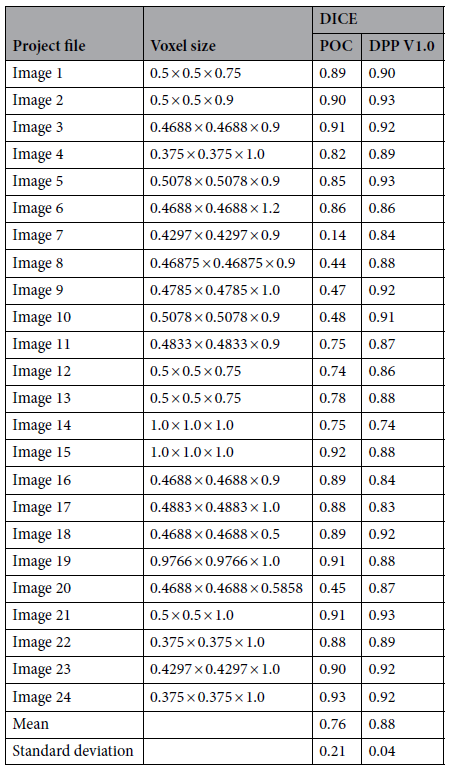
Simpleware 软件工程师使用的 POC 数据集由 25 个高质量 MRI 组成。143 个 MRI 的真实数据集分为训练组(80%)、验证组(10%)和测试组(10%)。通过基于 AI 和 ML 的算法和信息训练 Helper(DPP V1.0),在真实数据分割中识别肿瘤表现出色,未遗漏任何肿瘤。使用获得的 30 个新 MRI 扫描分割完成最终测试阶段,验证该工具在全新患者数据中识别和分割肿瘤的能力。计算 DICE 系数评估 AI 生成 3D 模型相较于放射科医师验证手动分割模型的准确性。
开发可视化工具
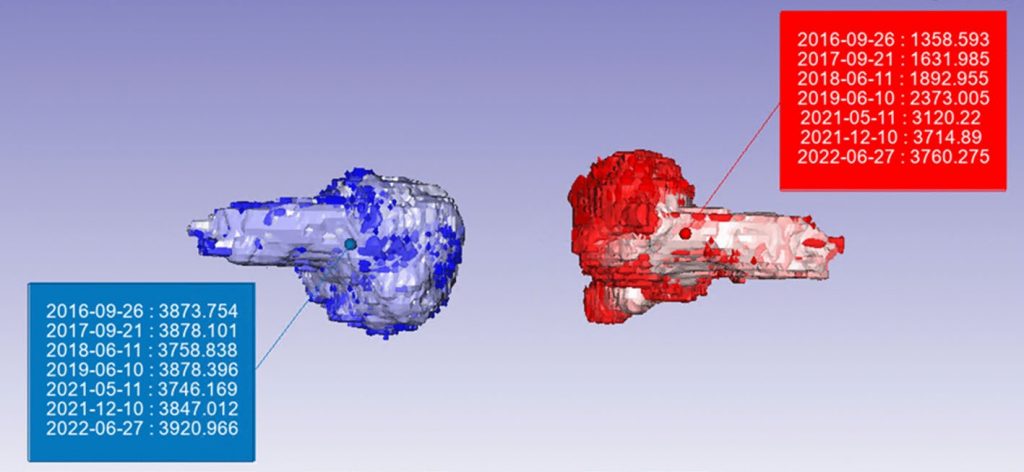
为比较患者肿瘤的生长时间,对每个患者均进行多次扫描。将分割的肿瘤导入同一个 Simpleware 项目文件中,采用图像配准算法对 DICOM 图像与生成的 3D 肿瘤模型进行脑部结构重构与空间校准。
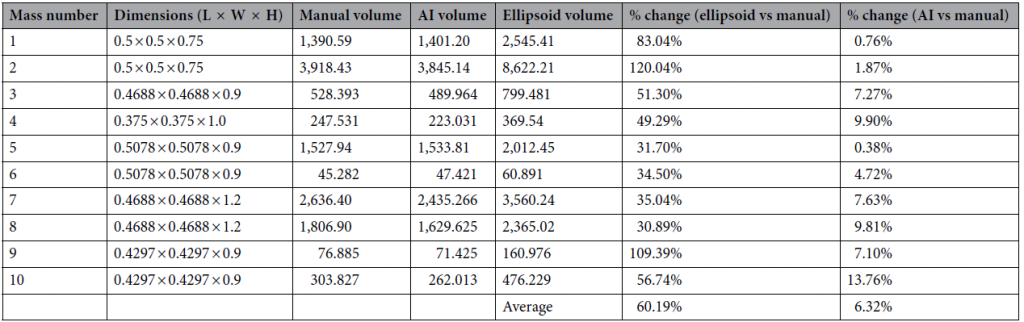
在 Simpleware 的脚本界面,编写自定义代码将双侧肿瘤按照时间顺序排列并分为左、右侧。用脚本生成图说明每个肿瘤大小随时间的变化,表明相对于基线的变化百分比和波动性。配置描述肿瘤生长时序性的颜色方案,每个肿瘤的重叠 3D 模型以单一颜色展示。早期扫描的肿瘤模型显示为较浅颜色,后期扫描为较深颜色。最终,通过3 种方法获得 10 个肿块的体积测量:手动分割、AI 分割和椭球体体积计算。
结果与讨论
虽然 3D 体积分析可以产生最准确的肿瘤大小测量值,但肿瘤的手动分割非常耗时,需要经过培训的临床医生和工程师执行操作且也因此引入了测量的可变性。而采用基于 AI 算法的全自动工具消除了主观性、误差以及对大量临床培训的需求,在极短时间内(小于 4 分钟)提供更准确的肿瘤尺寸测量结果,工作流的可重复性也提高了测量的临床有效性。
在模型的概念验证(POC)中,平均 DICE 评分为 0.76(标准差为 0.21)。最终测试阶段后平均 DICE 评分为 0.88(范围是 0.74-0.93,标准差为 0.04)。通过一组相同的 24 个图像数据比较 AI 工具初始 POC 和最终 DPP 版本在 DICE 评分上的改善,特别是 Image 7 的 DICE 评分由 0.14 大幅提高至 0.84。
比较连续成像以确定肿瘤生长是具有挑战性的,患者的头部很难在不同时间段位于 MRI扫描设备中完全相同的位置。为减少由此引发的不确定性,通过执行图像配准将所有的 3D 肿瘤模型叠加到先前的成像上,因此可以在多个维度上识别肿瘤生长的位置并评估肿瘤对脑桥和耳蜗神经等结构的影响。
本研究已证明通过 AI 驱动自动化图像处理进行肿瘤 3D 体积分析的可行性,验证了工具的准确性和可靠性。该 VS 软件的关键提升在于易用性,临床医生可以同时收集多个数据点如肿瘤体积测量数据、肿瘤与脑桥等周围结构的邻近性,以及通过叠加连续 MRI 比较 VS 生成以观察长入脑桥或耳道的特定区域。
总结
本研究证明开发的自动分割工具可以用于准确的 VS 肿瘤 3D 体积分析和肿瘤生长评估,便于患者了解疾病和进展,协助临床医生做出更明智的决策。该工具也可以用来研究药物的有效性,未来的一个关键研究方向是通过比较分析肿瘤以往的增长速率预测肿瘤的生长情况。
参考
- Jester N, Singh M, Lorr S, et al. The development of an artificial intelligence auto-segmentation tool for 3D volumetric analysis of vestibular schwannomas[J]. Scientific Reports, 2025, 15(1): 5918.
