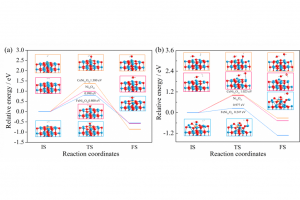
CLC作为一种低能耗、低污染的新型能源利用方法,是实现清洁生产和高效转化的研究热点。CLC过程的关键任务之一是载氧体的反应活性和机理研究。众所周知,燃烧等热化学转化过程的化学反应行为与反应物的结构密切相关。NiO、Fe2O3、钙钛矿和尖晶石材料在CLC中表现出不同的反应行为和机理,这些差异主要来自于各种载氧体的化学组成、颗粒尺寸、表面形态和化学键特征。尽管已经在实验中研究了CLC中各种反应行为,从多尺度分子模拟、反应动力学和材料表征的角度,尚未全面了解Fe/Co掺杂的镍基载氧体的反应行为和机理,仍然面临许多局限性和挑战。 因此,本工作通过多尺度分子模拟和实验结合研究CLC过程中Fe/Co掺杂的镍基载氧体的反应机理和行为。主要工作由三部分组,分别是本征反应机理和性能、非本征反应性能评价、材料表征揭示反应行为。首先,采用多尺度分子模拟研究Fe和Co掺杂的NiO载氧体和H2分子之间的本征反应的反应能垒和机理。使用IGM和EDA研究H2分子与载氧体表面之间相互作用的区域、类型和强度。然后,使用H2-TPR和TGA测试系列Fe和Co掺杂的镍基载氧体的性能,得到转化率和表观活化能。最后,从颗粒尺寸、形貌、表面等材料表征学揭示本征反应和非本征反应的差异。 研究要点一: ReaxFF MD模拟提供了直接证明H2与NiO相互作用生成H2O分子的反应是基元反应的证据。整个CLC过程中截取H2生成H2O的反应机理如图1所示,H2向活性位点扩散,并倾斜吸附在载氧体表面(图1(a))距离约为2 Å。紧接着O原子迅速向H2转移,H-H键断裂的同时形成H…O…H键(图1(b))。形成的不稳定的结构,Ni-O键随即断开生成H2O分子(图1(c))。当脱附完成时,H2O分子的H-O键长分别为1.464和0.960 Å,H…O…H键角约为125°。H2O分子进一步弛豫得到合理的结构,并远离载氧体表面。下面接着使用DFT计算探索反应物、产物和过渡态的结构和能量更准确地描述反应过程。 图 1 截取ReaxFF MD模拟反应过程H2生成H2O的过程(红色球、蓝色球和白色球分别是O、Ni和H原子) 研究要点二: H2吸附在4层2×2的NiO (001)周期性平板模型(如图2(a)所示),镍和氧原子各32个,表示为Ni32O32。考虑Ni原子被Fe/Co掺杂取代的NiO载氧体模型表示为MNi31O32(M=Fe、Co和Ni),如图2(b)所示。H2吸附在MNi31O32载氧体表面的吸附构象分别是H2垂直吸附在M-top、O-top和空位(分别表示为T1、T2和T3),以及H2平行吸附在M—O、M…Ni和O…O桥位(分别表示为P1、P2和P3),其中M=Fe、Co或Ni,如图4-2(c)所示。总共构建18个结构用于研究H2在镍基载氧体表面反应机理。载氧体的连续氧释放反应模型被考虑并表示为Ni32O31、FeNi31O31和CoNi31O31。 图 2计算结构模型:(a) 4层2×2 NiO超胞模型;(b) MNi31O32模型(M=Ni、Fe或Co);(c)吸附位点 研究要点三: 18种模型的Ebinding值范围为-0.236~-0.016 eV。H2在Ni32O32表面的P3构象Ebinding值最负(-0.192 eV),是最佳吸附构型。该结果与ReaxFF MD模拟的结果一致,H2分子倾向于平行吸附在Ni32O32表面的O…O键。P2是最不稳定的构型,Ebinding值为-0.0761 eV。如图3(a)所示,H2吸附在FeNi31O32和CoNi31O32表面的P3构象的Ebinding最负(分别为-0.212和-0.236 eV)是优势吸附构象。该结果与H2吸附Ni32O32表面的优势吸附构象一致。因此,H2分子倾向于平行吸附在Ni32O32、FeNi31O32和CoNi31O32表面的O…O键。除了T1和T3外,随着Fe和Co掺杂,大多数Ebinding值变得更负,这表明Fe/Co掺杂有利于H2在OCs表面上的吸附。 研究要点四: 采用能量分解对H2分子吸附在Ni32O32、FeNi31O32和CoNi31O32表面的稳定吸附构象进行分析。最稳定的吸附模型(P3)的EPauli分别为0.264 eV、0.227和0.251 eV,这表明Fe和Co掺杂减少排斥相互作用表现出显著地稳定效应,这可以有效地活化载氧体的晶格氧。相比之下,Eelstat、Eorb和Edisp在P3吸附构象对总吸引力的贡献比例不同。H2吸附在Ni32O32、FeNi31O32和CoNi31O32表面的P3,Eelstat(38.1、36.1和38.0%)和Edisp(34.3、36.7和35.3%)的贡献几乎相等,并且两种相互作用的贡献都大于Eorb(27.6、27.2和26.7%)。因此,静电和色散相互作用为主,其次是轨道相互作用。这与表现出较弱相互作用的体系不同。Ni32O32、FeNi31O32和CoNi31O32在T2的Edisp的贡献分别增加到65.9、64.9和67.8%,因此色散相互作用成为三个载氧体表面吸引力的主要贡献,Eelstat和Eorb的贡献均低于20%。T1吸附构型中,Ni32O32以Eorb(50.3%)为主,而CoNi31O32以Edisp(53.2%)为主。Eelstat(29.5%)、Eorb(35.9%)和Edisp(34.6%)构成了T3的总吸引力。根据EDA结果,通过不同吸附模型调节静电、轨道和色散相互作用可以有效地增强H2吸附载氧体表面。 研究要点五: 图3(b)总结了CLC中H2与Ni32O32、FeNi31O32和CoNi31O32载氧体的不同反应势能面、反应坐标和反应能垒(ΔEbarrier)。H2在Ni32O32表面的ΔEbarrier值在0.998~1.974 eV。H2在Ni32O32表面的反应,P3的ΔEbarrier最低(0.998 eV),P2最高(1.974 eV);FeNi31O32表面反应的ΔEbarrier值从0.800 eV (P3)到1.614 eV (T2);CoNi31O32表面反应的ΔEbarrier值1.380~2.677 eV。因此,Fe掺杂降低了反应能垒,而Co掺杂相反。FeNi31O32和Ni32O32最佳反应路径都是P3,没有改变最佳反应路径。Co掺杂改变了反应路径,这可能导致CoNi31O32载氧体ΔEbarrier增加的因素之一。除了反应路径和ΔEbarrier值之外,另一个原因可能是Co掺杂导致更负的Ebinding值(较低的IS结合能),使能垒增大。 图3 不同构象的(a) Ebinding和(b) ΔEbarrier○在(a)中表示最负的结合能;(b)中表示能垒最高。△在(a)中表示最大的结合能;在(b)中表示能垒最低。 图4(a)所示H2与Ni32O32、FeNi31O32和CoNi31O32载氧体反应的最低ΔEbarrier值分别为0.998、0.800和1.380 eV。载氧体的本征反应的活性顺序为FeNi31O32>Ni32O32>CoNi31O32。这可能归因于纯Ni32O32中引入掺杂剂导致M—O键和M…Ni(M=Fe或Co)相比完美Ni32O32的Ni—O键和O…O和Ni…Ni键扭曲。H2平行吸附于纯Ni32O32表面的O…O (P3),距离为2.724 Å。H2在FeNi31O32表面,虽然P3是优势吸附构象,但H2略微偏向掺杂的Fe原子。Co掺杂的优势构象H2吸附在掺杂的Co原子上(T1),并且更靠近表面(3.048 Å)。在TS结构中,氧原子分别在Ni、Fe和Co原子上,H2O分子位置保持不变,直到反应完成(FS结构)。Fe和Co掺杂对载氧体中的M—O键(M=Fe、Co或Ni)和晶格氧的影响不同,从而显着改变了反应能垒。图4(b)是Ni32O31、FeNi31O31和CoNi31O31连续释氧过程的反应坐标和路径。Ni32O31、FeNi31O31和CoNi31O31的ΔEbarrier值分别为0.977、0.247和1.023 eV,略低于第一个释氧的值,说明第二个释氧反应更容易。由于Ni32O31、FeNi31O31和CoNi31O31含有氧空位有利于CLC反应,这和之前的报道的一致。 图4最佳势能面的ΔEbarrier和结构 (a) Ni32O32、FeNi31O32和CoNi31O32表面;(b) Ni32O31、FeNi31O31和CoNi31O31表面 结论: […]
近期活动日历
周日周一周二周三周四周五周六日一二三四五六3012345678910111213141516171819202122232425262728293031123近期活动列表
- 没有活动
- 所有活动
标签
关于费米科技
费米科技以促进工业级模拟与仿真的应用为宗旨,致力于推广基于原子级别模拟技术和基于图像模型的仿真技术,为学术和工业研究机构提供研发咨询、软件部署、技术攻关等全方位的服务。费米科技提供的模拟方案具有面向应用、模型新颖、功能丰富、计算高效、简单易用的特点,已经服务于众多的学术和工业用户。
-
最近更新
- 通过生成对抗网络为异质和拓扑复杂的 3D 材料创建微观结构 2024年7月16日
- 气敏材料与器件的模拟 2024年7月12日
- 用于TPMS晶格生物陶瓷高分辨率3D打印的液晶显示技术 2024年7月10日
- ReaxFF力场、机器学习势、DFTB参数训练工具 ParAMS 正式发布 2024年6月30日
联系方式
- 留言板:点击留言
- 邮箱:sales_at_fermitech.com.cn
- 电话:010-80393990
- QQ: 1732167264
订阅费米科技新闻
- 邮件订阅:
您可以使用常用的邮件地址接收费米科技定期发送的产品更新和新闻。
点击这里马上订阅! - 微信订阅:
微信扫描右侧二维码。
- 邮件订阅: