实验-计算比对:为什么甲基橙是橙色的?
物质的颜色实际上是由该物质的可见光吸收谱决定的。自然光为白色光,那么如果吸收了红色波长的部分,剩下的就是绿色和蓝色、紫色的混合色了;相反地如果吸收了绿、蓝、靛、紫色光,剩下的就是红色和橙色的混合色了。
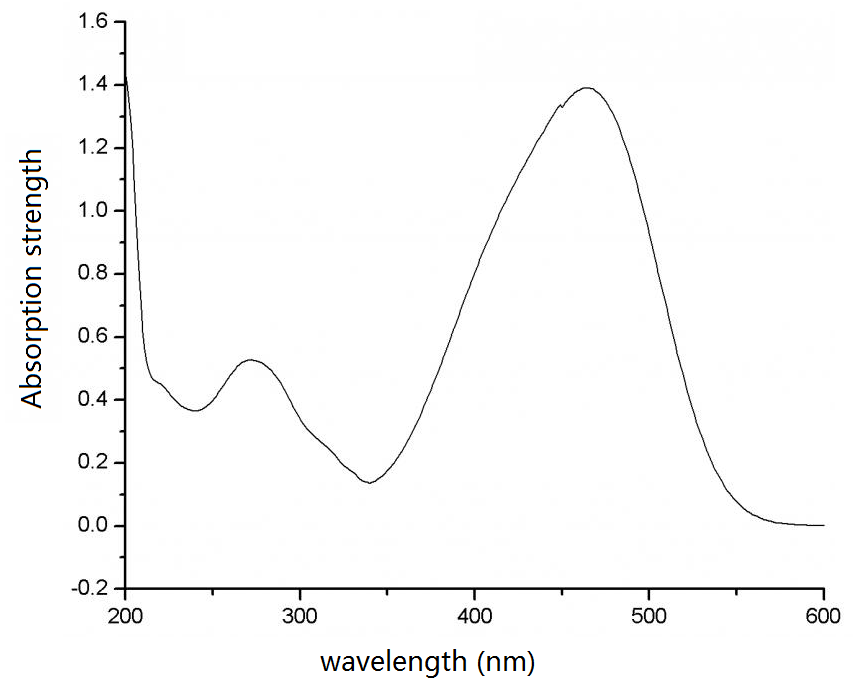
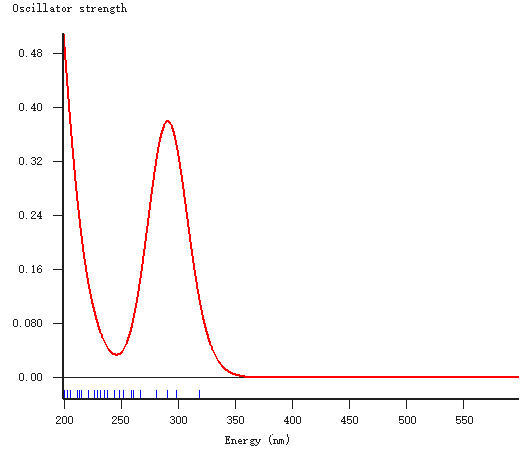
实验上测量甲基橙在溶液中的吸收光谱:
可见光的波长范围一般认为是390nm-760nm之间。
红光:波长范围:760~622纳米; 橙光:波长范围:622~597纳米; 黄光:波长范围:597~577纳米; 绿光:波长范围:577~492纳米; 青光:波长范围:492~450纳米; 蓝光:波长范围:450~435纳米; 紫光:波长范围:435~390纳米
从上述的吸收光谱来看,短波光都被甲基橙吸收掉了,剩下了可见光的长波部分,也就是红色和橙色、黄色部分,以及少量的绿色部分。
我们也可以使用密度泛函计算一下吸收光谱:
为了模拟甲基橙在水中的情况,我们考虑了一些Na离子附近的水分子。而其他位置的水分子与甲基橙分子只是形成非常弱的相互作用(范德华力),对吸收光谱影响不太大。因此
第一步:优化该分子的结构:
第二步:使用前一步优化得到的分子结构计算该分子的吸收谱(也就是激发态):
更详细的参数设置,参见费米维基:文献重现:锌酞菁的基态与激发态计算(第二部分)
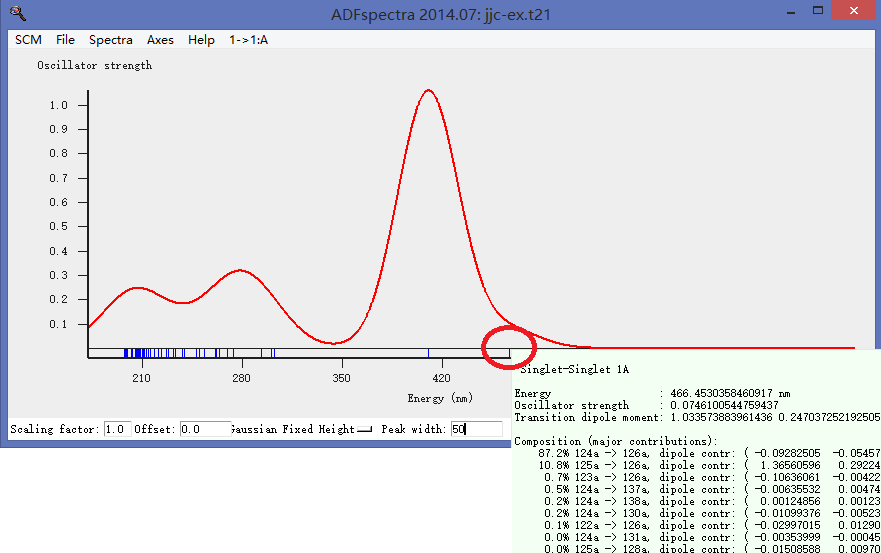
第三步,查看计算得到的吸收谱:
注意计算得到的是吸收峰,而实际由于分子的碰撞、振动,会导致吸收峰展宽,一般采用Gaussian展宽,本例中如上图所示,将峰宽设置为50。与实验得到的吸收谱在可见光范围内非常一致。
对于200nm以上的高频波段为何计算得到的x吸收谱和实验相差很大呢?这是因为我们并没有计算高激发态。我们只计算了50个激发态(在第4图中可以看到该设置),更高的激发态对吸收谱(激发能更大,也就是对波长更短的光的吸收情况),本例没有进行计算。
第四步,进一步分析这个吸收是由什么基团贡献出来的:
从上图看到,可见光区域主要有两个吸收峰,其中最大的一个就是鼠标移动到上图所示的位置的峰,鼠标移动到该峰顶部,自动出现该吸收峰的构成——可以看到,主要是电子从第125号轨道跃迁到126号轨道造成的——也就是从HOMO(最高占据轨道)跃迁的LUMO(最低空轨道)造成的。
注意:125A、126A,其中A是不可约表示符号,A表示分子没有对称性,因此只有一个不可约表示存在。
我们来看看这两个轨道是什么样子:
右键点击第125号轨道,并选择第一项(即轨道序号):
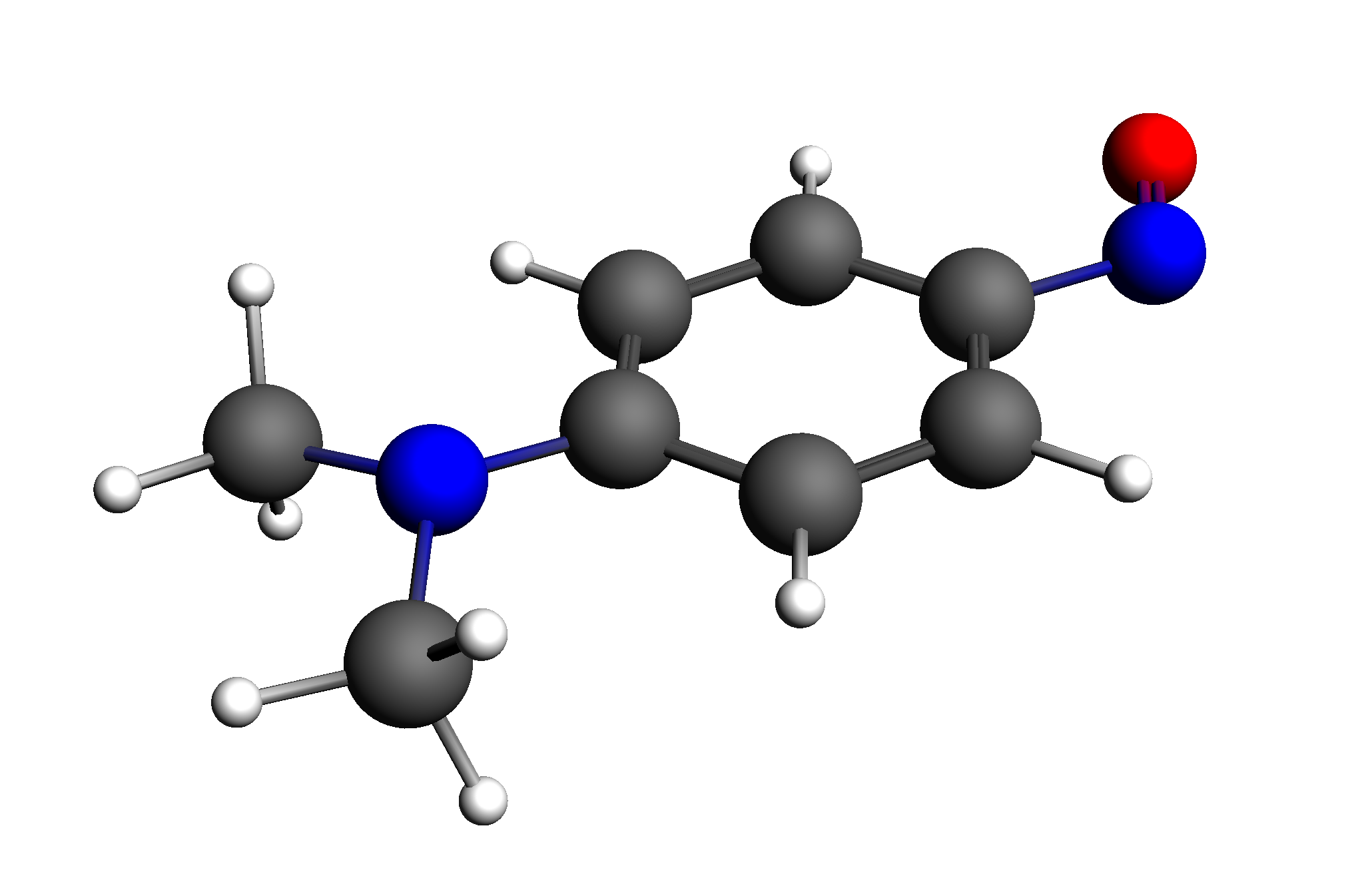
稍等片刻,即弹出125号轨道的图形,可以看出,主要是由N=N键左边的部分原子贡献出来的:
类似地方式,获取126号轨道,可以看出,主要是由N=N键贡献出来的:
类似地分析466nm处的吸收峰,可以看到,主要是电子从HOMO-1轨道跃迁到LUMO造成的:
那么我们设想,如果氧气分子将N=N双键打开,这样126号轨道将不复存在,这样对蓝-紫之间的吸收也就没有了,绿色部分的吸收同样地也没有了,溶液的橙色会改变?
答案是肯定的,我们用同样的方式分别计算氧气分子打开N=N之后得到的产物的吸收光谱,发现它们对所有可见光都不吸收,它们的溶液是透明无色的。
分别计算:
上述两种产物的吸收光谱,得到如下谱图:
发现,两种产物在可见光(390nm-760nm)范围内,没有任何光吸收。因此溶液显现为透明、无色。
另外,甲基橙的吸收光谱分别由HOMO、HOMO-1、LUMO贡献出来,而从这三个轨道的来源看来,Na、水分子都几乎没有贡献,这就是为什么甲基橙在溶液中和固体状态下颜色大致一致的原因。另外氢键可能与-N=N-略有影响,而略微改变126号轨道的能量,进而会导致吸收峰略微偏移。
ADF软件提供免费试用,试用申请方式参见费米维基:AMS免费试用