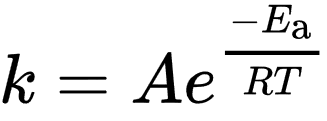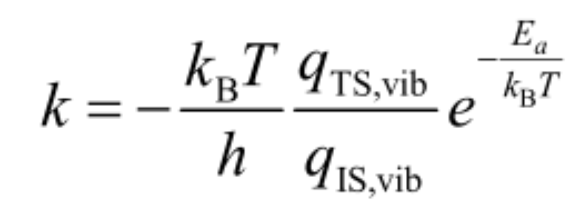adf:arrheniuseq
这是本文档旧的修订版!
化学反应速率相关公式
一,实验角度:Arrhenius公式
- k,反应速率常数(frequency of collisions resulting in a reaction)
- T,绝对温度,单位K
- A,指前因子,单位与k相同,衡量碰撞频率的一个因子,因此也称为“频率因子”
- $E_a$,(考虑零点能修正的)活化能
- R = 8.31446261815324 $J⋅K^{−1}⋅mol^{−1}$
二,计算角度:过渡态理论与简正频率得到反应速率常数
- $k_b$,玻尔兹曼常数,$k_b$ = 1.380649 × 10$^{-23}$ J/K
- T,绝对温度,单位K
- h,普朗克常数,h = 6.62607015×10$^{-34}$ J·s
- $E_a$,考虑零点能修正的活化能
- q$_{TS,vib}$,过渡态结构的振动分配函数
- q$_{IS,vib}$,起始结构(反应物结构)的振动分配函数。注意:
- 有的人搞不懂,反应物是两个分子,频率是谁的频率?这是由于没有搞懂何为第一性原理!第一性原理里面,薛定谔方程也好,Kohn-Sham方程也好,有键的定义吗?没有。它只关心原子的坐标,以及电子的个数。至于你这个体系是几个分子,它毫不关心。看起来几个分子,那是人为掺入的认知!是否成键,也是人为的认知与定义!成键与否,不是第一性(原理)。
- 过渡态结构有多少原子,多少电子,那么Initial State就一样多原子、电子,因为相同的粒子,能量才有可比性。
- i,振动模式
- γ$_i$,模式i的振动频率,单位赫兹(即 s-1)
三,振动分配函数得到熵
adf/arrheniuseq.1693651791.txt.gz · 最后更改: 2023/09/02 18:49 由 liu.jun