这是本文档旧的修订版!
使用NBO、NLMO分析NMR化学位移、EFG贡献来源
局域分子轨道方法,如自然键轨道(NBO)或自然局域分子轨道(NLMO),可以帮助分析和解释电子结构性质。本教程分析了邻位、亚位和对位的NH2和NO2取代基对苯环中芳香碳原子核磁共振化学位移的影响。人们通常认为,芳香系的这些位移是由这些原子的π轨道电子的耗尽或积累引起的。本例中,我们使用ADF和NBO/NLMO分析工具通过NMR计算验证了这一说法。
本案例主要复现该文献结果:
三种分子坐标(已优化过):
- 下载 Benzene.xyz
- 下载 Aniline.xyz
注意:应该先调整三个分子坐标一致,使结果具可比性
使用局域分子轨道方法分析NMR、EFG,对不同的分子进行比较的时候,要注意分子的取向、位置,因为像NLMO这种方法,结果就是跟分子的位置和朝向有关。因此像本例中,我们可以通过ADFinput里面的Edit → Align功能、Edit → Set Origin功能把这3个分子的苯环放在同样的坐标、坐标系里面。可以选中苯环的6个C原子,然后Edit → Set Origin。这样苯环的中心就是坐标原点了,然后选择CH、CN、CN,然后Edit → Align → with X axis,将CH、CN、CN方向设定为X轴,这样三个分子就在同样的位置上了。结果也就具有了可比性。
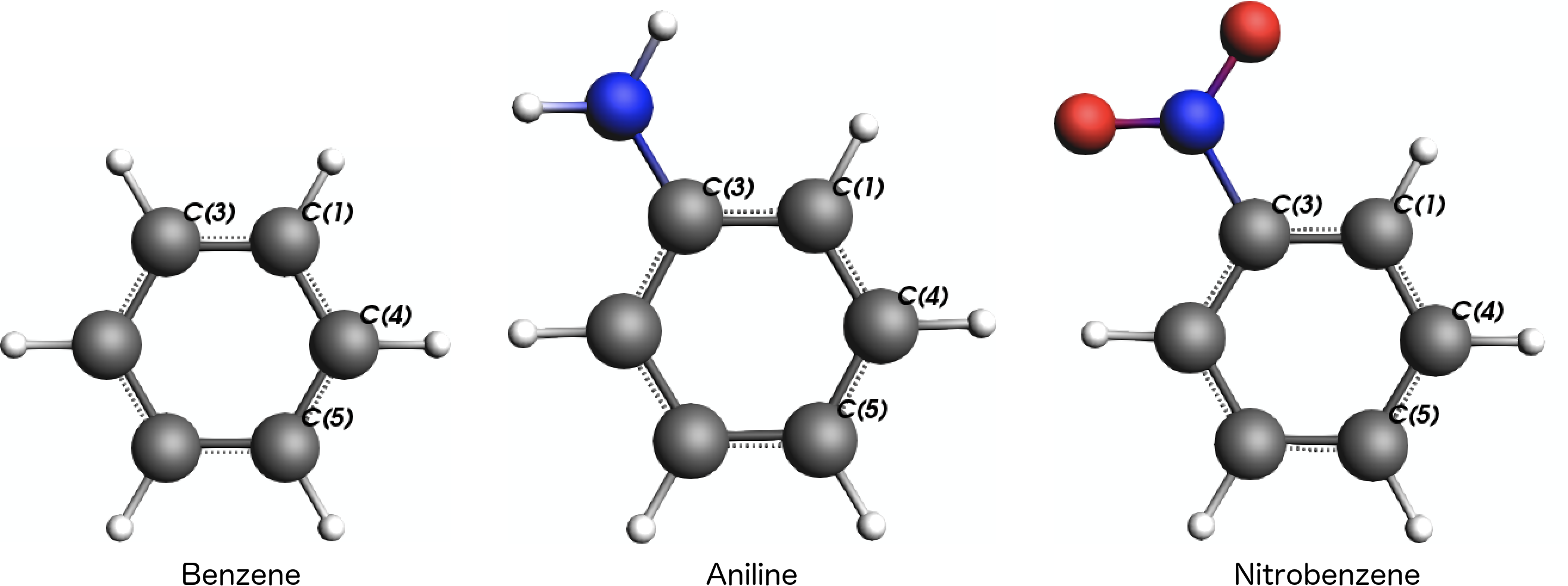
本例中,是为了比较如下图所示的1、4、5号原子的NMR化学位移:
三个分子的1、4、5号原子位置都是一一对应的。
参数设置
ADFinput → File → Import Coordinates,导入Benzene.xyz,并设置参数如下。其中NMR计算是需要设置数值精度Numerical Quality为Good,以及Frozen Core为None,基组为TZ2P,重一些的元素需要用QZ4P:
设置溶剂化效应,分别选择溶剂化方法和溶剂:
选中1、4、5号原子,Properties → NMR,然后点击窗口右边的➕则出现C(1),C(4),C(5),表示程序将计算1、4、5号原子,这3个原子都是C。同时勾选一下另外两个选项,如图所示:
Properties → Localized Orbital Orbitals,NBO,并选择如下:
表示将使用NBO、NLMO方法来分析NMR性质,当然如果Analyze properties选择EFG,则会分析EFG性质。
Details → Symmetry设置为Nosym:
Details → 勾选Full fock matrice:
保存任务,并提交作业。
类似的计算另外两种分子。
结果查看
1,NMR化学位移比较
SCM LOGO → logfile,在logfile的尾部,有各向同性NMR化学位移数据,其中Benzene的结果:
<Dec12-2018> <17:41:22> NMR Shielding ADF-GUI atom C(1): 54.30 ppm <Dec12-2018> <17:41:22> >>>> ZSIGALL <Dec12-2018> <17:41:34> NMR Shielding ADF-GUI atom C(4): 54.30 ppm <Dec12-2018> <17:41:34> >>>> ZSIGALL <Dec12-2018> <17:41:46> NMR Shielding ADF-GUI atom C(5): 54.30 ppm <Dec12-2018> <17:41:46> NORMAL TERMINATION
类似得到另外两种分子的NMR化学位移的计算值。实验值和计算值之间需要进行平移,才能比较。实验测量的Benzene的化学位移 $δ_Benzene$ = 128.55 ppm,以此作为参考。我们套用公式:
$δ_i = σ_Benzene - σ_i - δ_Benzene$,其中i表示三种分子Benzene、Aniline、Nitrobenzene,其中$δ_Benzene$ = 128.55 ppm,$σ_i$是ADF计算得到的位移值。这样平移之后,得到所有的化学位移值,这些值,可以与实验值进行比较:
计算值和实验值误差基本在2ppm左右,并且趋势一致:$NH_2$使得邻位、对位位移显著减小;亚位几乎不受$NH_2$影响;NO2取代的情况下邻位减小,对位增加,亚位几乎不受影响。为了合理化解释这一现象,我们来研究轨道对这些取代基效应的贡献。
2,NMR化学位移来源研究
我们首先研究各个NLMO对各项同性屏蔽张量的贡献,输出文件中包含C(1)、C(4)和C(5)各向同性屏蔽张量的NLMO和NBO分解情况。NMR屏蔽张量由逆磁贡献和顺磁之和构成。逆磁项较大,但主要是内层电子轨道的贡献,基本上不受原子的周围环境影响。而我们感兴趣的取代基效应,即改变原子周围的环境,因此我们集中关注顺磁项,对化学位移的大小和方向的影响。
我们现在来查看Aniline分子中,各个原子NMR化学位移的贡献来源。SCM LOGO → Output,窗口底部输入:
NLMO contributions to *** Isotropic Shielding Tensor
并回车,可以搜到3个,依次是1、4、5原子的贡献情况。例如第1个原子的顺磁相贡献来源情况:
NLMO contributions to *** Isotropic Shielding Tensor *** Print thresholds: 1.732 (Para + SO) 2.426 (Dia) 0.694 (Total) , in ppm In the following, i is the index of an NLMO as characterized in the NBO program output *** Paramagnetic + SO *** NLMO # Lewis Non-Lewis L+NL % NBO # (occup. ) parent NBO Label -------------------------------------------------------------------------------------------- 9: -49.931 -0.870 -50.801 99.0 9. (1.98065) BD ( 1) C 1- C 3 10: -52.725 -1.517 -54.241 99.1 10. (1.98278) BD ( 1) C 1- C 4 11: -6.108 0.716 -5.391 83.9 11. (1.70876) BD ( 2) C 1- C 4 12: -57.122 3.958 -53.163 99.0 12. (1.97995) BD ( 1) C 1- H 7 14: 1.223 1.268 2.491 83.1 14. (1.67968) BD ( 2) C 2- C 5 17: -5.632 2.695 -2.937 99.0 17. (1.98071) BD ( 1) C 3- C 6 18: 1.219 -0.647 0.572 80.4 18. (1.62831) BD ( 2) C 3- C 6 19: -3.076 0.771 -2.305 99.5 19. (1.99097) BD ( 1) C 3- N 14 20: -6.587 3.990 -2.597 99.2 20. (1.98466) BD ( 1) C 4- C 5 21: -3.915 1.243 -2.672 99.0 21. (1.97946) BD ( 1) C 4- H 8 24: 0.514 -1.819 -1.305 99.3 24. (1.98637) BD ( 1) H 12- N 14 -------------------------------------------------------------------------------------------- sum: -182.140 9.791 -172.349
“* Paramagnetic + SO *”表示顺磁项的贡献情况列表,可以看到,贡献最大的三个:-50.801、-54.241、-53.163三个来源分别是C1-C3、C1-C4、C1-H4原子之间的NLMO。往下分别可以看到“逆磁项”的贡献情况列表,以及总的贡献列表。其中总的贡献列表是最重要的,也是我们最关注的。
NBO的贡献也是类似的。搜索“NBO contributions to *** Isotropic Shielding Tensor”也可以找到对应的三处,对应1、4、5三个原子的情况。
3,查看NLMO或NBO
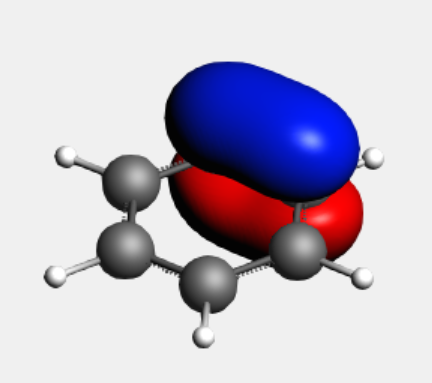
SCM LOGO → View → Add → Isosurface :With Phase → 窗口底部Select Field … → NLMOs..,分别选中如下绿色所示9、10、12三个编号的NLMO可以显示其形状,窗口底部等值面的值,由默认的0.03改为0.06,显示如下:
这三个贡献最大的NLMO都明显具有σ轨道特征,而贡献很小的11号NLMO则具有π轨道的特征:
类似可以查看NBO轨道,结果类似。
总之,芳香环的化学位移主要由σ轨道贡献而非π轨道。
延伸阅读
- R. V. Viesser, L. C. Ducati, C. F. Tormena and J. Autschbach The unexpected roles of σ and π orbitals in electron donor and acceptor group effects on the 13C NMR chemical shifts in substituted benzenes, Chem. Sci. Phys. 8, 6570-6576 (2017).
- J. A. Bohmann, F. Weinhold and T. C. Farrar Natural chemical shielding analysis of nuclear magnetic resonance shielding tensors from gauge-including atomic orbital calculations, J. Chem. Phys. 107, 1173-1184 (1997).
- J. Autschbach Analyzing NMR shielding tensors calculated with two-component relativistic methods using spin-free localized molecular orbitals, J. Chem. Phys. 128, 164112 (2008).
- R. V. Viesser, L. C. Ducati, C. F. Tormena and J. Autschbach The halogen effect on the 13C NMR chemical shift in substituted benzenes, Phys. Chem. Chem. Phys. 20, 11247 (2018).